Chemie pro šílence
2. března 2014 v 6:05 | Petr
Jestli jste drželi v ruce CD tak víte co je polykarbonát a můžeme skončit ....
Na druhou stranu asi byste byli zklamaní, že dnešních 800 slov jsem takto ošidil. Takže - když jsem psal o molekule, že které mají spermie (a paní Kubáčová) opravdovou hrůzu - zmínil jsem, že bisfenol A se používá i na výrobu polykarbonátu.
A skutečně je to tak. Zatímco moje manželka má hrůzu z bisfenolu A. My chemici víme, že to je látka relativně neškodná. To výroba polykarbonátu je jiné kafe. Klasický a nejběžnější polykarbonát se vyrábí reakci bisfenolu A s fosgenem.
Fosgen to je ta molekula uprostřed vzorečku
Cl - C=O - Cl je to vlastně formaldehyd, který místo vodíků mác chlory. Mimo to, že to je základní surovina chemických syntéz, tak byl velmi populární za I. světové války jako opravdu nebezpečný bojový plyn. Takže jestli při havárii v továrně na Epoxid budet mít přechodně zduželá prsa a horší spermiogram, po havárii v továrně na polykarbonát - bude vaše manželka vdova a bude mít znovu volné ruce k hledání muže s dobrým spermiogramem.
Pozoruhodnou vlastností klasického polykarbonátu je to že karbonátová skupina -O-CO-O- která je velice polární se pravidelně střídá s nepolárními benzenovými jádry původně z bisfenolu. To umožňuje aby se polární i nepolární části molekul vzájeně do sebe zaklesly a výsledkem je nejpevnější existující opticky čirý plast. O něco méně houževnatý je polyester (PET láhve) , ještě méně pevný je polymethylmetakrylát alias plexisklo a úplně křehký je polystyrén - a to je z "organických skel" všechno....
Obyčejný polykarbonát má lineární řetězce a vlastnosti termoplastu (teplem se taví a chladnutím opět tuhne). Chemikům se to ještě nezdálo dost, proto existují i polykarbonáty se síťovitou strukturou a vlastnostmi termosetu. Pro svůj vysoký index lomu a vysokou cenu se používají především na čočky brejlí - zkuste se pozeptat kolik stojí "lehčené" plastové čočky a dáte mi za pravdu.
Polykarbonát obecně je trošku dražší než plasty z kategorie "nejsprostších" plastů, proto se používá relativně málo a opravdu jenom tam, kde jsou jeho vlastnosti využity. Nicméně viděl jsem robota celého postaveného z instalačních CD starých Windows - proto stojí za to probrat otázku lepení, která je dětsky jednoduchá - epoxidy - zejména ty houževnaté rychleschnoucí a kyanoakrylát (vteřinové lepidlo) pro lepení epoxidem je vhodné povrch zdrsnit, pro lepení čímkoliv je nutno cédéčko důkladně odmastit.
Poslední nepatrný problém - je vrtání. Rád bych poradil geniální postup, ale nemám takový -polykarbonát je houževnatý pružný a úporně se vrtání brání, když se pak vrták zakousne má tendeci se roztříštit - snad bych doporučil, že nejméně problematické je vysokoobrátkové vrtání malými vrtáky a postupné zvětšování díry většími a většími vrtáky se stále menšími otáčkami.
Zbývá nám už jenom rada robotům ke zničení lidstva - když už si nemůžete dovolit mít kovovou lebku v polykarbonátové přilbě pořiďtě si alespoň polykarbonátové kryty kamer ...
23. února 2014 v 6:36 | Petr
Na 100 let vývoje elektroniky jsme spotřebovali skoro 70 díllů vidláků - co tedy s 10000 letým vývojem chemie - tento seriál se začíná vymykat kontrole...
Ale přesto - dneska je na pořadu dne
vinyl-acetát a jeho polymer
poly-vinyl-acetát. Nápis polyvinylacetát jste patrně jen tak na nějakém výrobku nečetli nicméně setkali jste se s ním všichni - když já řeku polyvinyacetát - vy musíte vykřiknout
Herkules,
Dispercoll, nebo
Duvilax bratři anglosassové mohou vykříknout
wood / carpenters glue.
Vážení přátelé ano - vinylacetát - je to bílé v pixle (ve skutečnosti je už částečnně polymerizovaný) a vyschnutím vody ze směsi dojde k polymerizaci na polyvinylacetát. Z praktického hlediska je nutno poznamenat, že polymerizovaný polyvinylacetát je už ve vodě nerozputstý - přestože ji částečně pohlcuje a tím poněkud bobtná.
Když už jsme řekli Herkules - musím se slzou v oku vzpomenout na toto lepidlo, které jako jedna z mála věcí "pro geeky" byla zcela bez problémů sehnatelná i na sklonku bolševika.
Jaký je polyvinylacetát plast ? Patrně už jse odněkud sloupli kapku zaschlého Herkulesu takže tušíte, že je to měkká, pružná hmota.
Když se podítváte na vzoreček - je to jasné - na centrální "polyethyllénový" řetězec jsou navázány esterové skupiny se zbytkem kyseliny octové na konci. To dává lepidlu dvě vlastnosti - na podložku se může vázat jednak vodíkovým můstkem vycházejícím z kyslíku =O a jednak hydrofobními interakcemi - koncové CH3 skupny.
Je mi jasné, že jste z toho jeleni, proto nastala nutnost dalšího "školského okénka" a je nuto probrat věc zvanou "
mezimolekulové interakce". Neberte to moc tragicky - mezimolekulové interakce jsou jednak chemické vazby, které drží molekuly opravdu pevně pohromadě a jednak nevazebné síly, o kterých se v chemii učí jenom málo - ačkoliv ony rozhodují o vlastnostech materiálů především - viz kapitola o
nylonu-6 a nylonu-66. Takže držte si klobouky jedeme v pořadí klesající vazebné energie - tedy energie nutné k tomu abychom danou vazbu rozštěpili.
- Iontová vazba - de facto žádná vazba není protože jeden atom ukradne druhému elektron a už mu jej nedá - příklad chlor ukradne sodíku elektron a ve slané polívce už si plavou každý sám - vtip je v tom, že chemici považují tuto vazbu za "silnou" protože ukrást chloru elektron a vrátit jej sodíku vyžaduje obrovskou energii
- Kovalentní vazba - každá molekula má prostory - zvané orbitaly - kde se pohybují její elektrony - kovalentntí vazba znamená, že molekuly "sdílejí" společné elektrony ve společném orbitalu. V praxi to vypadá tak jak byste si představovali - dva monomery se "sváží" kovalentní vazbou a pak už jdou spolu jako jedna nová molekula.
- Různé kommplexové a koordinačně kovalentní vazby - vynecháváme neb nám zatím k ničemu nejsou
- Vodíkový můstek - vodík má jenom jeden elektron, pokud o něj přijde (třeba ve vodě) holý proton se snaží být co nejblíže atomům, které mají přebytek elektronů - voda je kapalná - díky vodíkovým můstkům - sirovodík, který má zcela stejnou strukturu jako voda - je za stejné teploty a tlaku smradlavý plyn - síra je sice 2x těžší a větší atom než kyslík, ale neposkytuje elektrony do vodíkových můstků....
- Wan der Waalsovy síly - polární - i některé nepolární molekuly se k sobě otáčejí opačně nabitými částmi a slabě se přitahují.
- Hydrofobní interakce - pokud mají molekuly nepolární i polární části - nepolární části se snaží uchránit kontaktu s polárními tím že společně vytváří regiony nepolárních molekul - které jsou "vzájemně rozpuštěné" jedna v druhé. Krásný makroskopický příklad jsou kapky oleje ve vodě - tedy pokud si představíte kapky velikosti jen několik atomů - víte o čem je řeč.
Vrátíme - li se k poylvinylacetátu - tento je poměrně blízce příbuzný polymethylmetakrylátu - tedy plexisklu - díky této příbuznosti se polyvinylacetát dosti často používá jako rozpouštědlo různých akrylátů v akrylových barvách. Jinak jako lepidlo potřebuje polyvinylacetát nějaké ty kyslíky a vodíky k vytvoření vodíkových můstků - proto lepí nejlépe polymery které obsahují mnoho -OH (hydroxylových skupin) - což jsou přírodní polymery na polysacharidové bází - tedy celulózu - alias dřevo a papír. Dřevo lepí opravdu dobře - navzdory obecné představě, že to je jen tak nějaké podřadné lepidlo. Naopak hydrofobní interakce se celkem dobře uplatní při lepení pěnového polystyrénu, na který je Herkules taky docela dobrý. Ostatní materiály - molekuly bez výrazně hydrofobních částí a OH skupin - zapomeňte že byste je slepili.
Tolik tedy lepidlo, kterého mám 2 kila v pixle na polici a vzpomínám na něj se slzou v oku. Zbývá už jenom rada robotům ke zničení listva - jelikož roboti patrně jen tak nebudou dřevění nebo papíroví - polyvinylacetát vám asi k ničemu nebude - leda by vaše zákeřnost přerostla veškeré meze a v rámci podloudného oblbnutí lidstva byste začali provozovat školky pro dětičky a vystřihovali a slepovali s nimi barevné papíry.
16. února 2014 v 5:29 | Petr
Bývaly doby, kdy mě bratr opakovaně provokoval výrokem, že jeho známí "
pracují v PVC" - což bylo, de facto, přeslechnutí, protože on tím myslel
PWC. Takže všechny shoppaholičky lačné bohatého manžela, musím zklamat - dnes se nebudeme zabývat korporacemi s obratem "
od miliardy výše", ale pohnutou historií
polyvinychloridu.
Žíháme li nehašené vápno v obloukové peci s uhlím dojde k následující reakci
CaO + 3C = CaC2 + CO.
Tím nám vznikne karbid vápníku, na který pokud kapeme vodu vznikne plyn acetylén. Takhle se vyráběl "karbid" po desetiletí a před rozšířením elektriky byly "lampy karbidky" hlavním zdrojem světla pro domácnosti ještě vedle "lamp petrolejek". Na přelomu 19 a 20 století došlo k elektrizaci domácností a celý byznys s acetylénem (který se krom toho získává i krakováním černouhelného dehtu nebo ropy) se zhroutil.
Acetylén natolik klesl v ceně, že podnikaví chemici typu
strýčka Františka ze Saturnina začali mít snahu "
něco" z acetylénu vyrábět - cokoliv když je acetylén tak laciný. Takže v roce 1912 začali Němci vyrábět vinylchlorid reakcí acetylénu s chlorovodíkem - kapalný vinylchlorid jim pak "ve flašce" spontánně polymerizoval na PVC - které v podobě "
pra-PVC" mělo podobu polotekuté smradlavě "
hňahňaniny".
Z Německa 30 let mimochodem pochází i v Česku známý pojem "igelit" - my tím označujeme spíše fólie z polyethylénu, ale původě IGELIT je složenina dvou slov - zkratky chemické fabriky IG farben (neblaze proslulé výrobou cyklonuB pro koncentráky) a koncovkou LIT - kterou vzali z komerčního názvu jediného tehdy běžného plastu kterým byl bakeLIT. Takže "igelit" v Něměcku je paradoxně PVC.
Co se týče vlastnotní PVC - to se poměrně dosti podobá polypropylénu - od houževnatých tvrdých plastů známých pod názvem "Novodur". po nafukovací plavecké kruhy a zvířátka z měkčeného PVC.
Polypropylén ma na základní "ethylénový" řetězec navázané methylové skupiny - CH3. Polyvinylchlorid má ve stejných místech atom chloru což mu dává "polární" vlastnosti.
Tím musíme udělat odbočku k pojmu "
polarity molekul" Každý atom váže elektrony jinou silou, takže máme extrém č. 1 a to jsou alkalické kovy (sodík) , které zejména ty těžké cesium, francium odštěpují elektron extrémně snadno - prakticky o svůj elektron vůbec nestojí - a proto kdykoliv mohou vyskytují se jako kladný iont Na
+, K
+,. Rb
+, Cs
+, Fr
+. Tyhle prvky jsou v periodické soustavě vlevo dole - na opačném konci periodické tabulky - vpravo nahoře je Fluor a Chlor, které jeden elektron extrémní silou přitahují a tudíž se skoro vždy vyskytují jako záporné ionty Cl
- F
-. Schopnosti vázat (odštěpovat) elektron se říká
elektronegativita, což je nepodstatný školní brept, co je podstatné, je že pokud je celá molekula z jenoho (dvou) druhů atomů jako jsou
UHLO -
VODÍKY tak je síla která poutá elektron k atomu všude v molekule stejná a tudíž rozložení "
hustoty elektronového mračna" (viz kvantová mechanika) je všude stejné a tudíž se molekula jeví jakoby neměla žádný náboj. Pokud ale místo vodíku dáme na jeden konec chlor. který přitajuje elektrony více než vodík "
na druhém konci" Chlor si přitáhne elektrony k sobě a tímse tento konec molekuly začne jevit jako záporně nabitý a druhý konec kde je "
holý vodíkový proton" se začne jevit jako kladně nabitý.
Tím jsme tedy vysvětlili že PVC je polární na rozdíl od polypropylénu, a z toho vyplývají jeho vlastnosti a praktické využítí - díky polarite se dá lépe lepit (novodurové odpadní roury) a barvit (barevná iolace kabelů). Na druhé straně je je daleko horší izolant než polyethylén (izolace koxiálů bývá z pěnového polyethylénu). PVC méně odolává vodě (protože ji tolik neodpuzuje). Ale zejména jeho pálením vznikají jedovaté produkty včetně fosgenu a chloru, oxidů chloru a dalšich chlorovaných uhlovodíků.
Jelikož PVC patří k "nejsprostším lidstvu známým plastům" dále se jím zabývat je myslím zbytečné. Zbývá už jenom rada robotům ke zničení lidstva - jestli budete útočit chlorem nezapomeňte, že napadá nejenom vše živé ale i řadu kovů a plastických hmot - tak si dávejte pozor na dráty a ložiska - neřádi ;-)))
9. února 2014 v 6:16 | Petr
Vážení roboti a jejich páníčci.
Velice pochybuju, že byste ve škole (snad kromě Školy Vysoké Chemické ) probírali tak podrobně plasty - nicméně když jste šťouravý typ - jako já - tak od prostých vlastností umělých hmot z Baumaxu časem dojdete až tam, co dneska probíráme. Potíž je v tom, že se nám nahromadíly pojmy, které je třeba vysvětlit jako ve škole, jinak bychom se v příštích dílech chemie zamotali natolik, že bych byl za šílence a vy byste mi patrně nerozuměli.
Jistě jste už pochopili, že mezi chemickou strukturou a vnějšími - chemicko - mechanickými vlastnostmi každého plastu je jasný vztah - nyní je však nejvyšší čas přestat se skrývat za různými zjednodušeními a vysvětlit celou věc na plnou hubu. Berte tedy dnešek jako otravnou "mezihru" nutnou pro další výklad a zároveň jako slovníček pojmů.
- Homopolymery - plasty vyrobené z jedné komponenty - příklad - polyethylén, polypropylén, nylon-6.
- Heteropolymery - plasty vyrobené z více komponent - příklad - nylon-66, epoxidová pryskyřice.
- Kopopolymery - plasty vyrobené tak, že kus molekuly je jeden typ a další kus molekuly je jiný typ (budeme probírat)
- Termoplasty - plasty, které se vysokou teplotou taví - při chladnutí tuhnou a dají se opět roztavit - toto chování je typické pro plasty s dlouhými nesíťovanými molekulami. Příklad - polyethylén, polypropylén. Tato vlastnost se využívá při zpracování (lisování, vstřikování za tepla).
- Termosety - plasty, které vysokou teplotou tvrdnou po ochlazení zůstávají tvrdé a nedají se znovu roztavit - typické pro síťované plasty, které při vysoké teplotě jenom vytvoří vice vazeb mezi molekulami - Příklad - bakelit, epoxid.
- Elastomery - molekuly, které vytvářejí pružné plasty (pryže) toho se dosahuje jistým stupněm zesíťování struktury jistého druhu polymeru (probereme).
- Hydrofilní (polární) molekuly - molekuly, které se rozpouštějí ve vodě nebo jiných polárních rozpouštědlech - naopak v nepolárních rozpouštědlech (toluen, hexan) vytvářejí kapky.
- Hydrofobní (nepolární) molekuly - molekuly, které se rozpouštějí v nepolárních rozpouštědlech a ve vodě tvoří mastné kapky.
Aby to nebyla taková nuda dáme si na závěr jistý myšlenkový experiment, abychom pochopili jak chemici "vaří plasty" s vlastnostmi "na objednávku". Představte si že máme molekulu jejíž strukturu si můžeme naklikat v počítači a sledovat jaká hmota tím vznikne.
Takže si přestavte že začneme s polymerem o několika monomerech - ten bude mít vzhled viskóz ní kapaliny a to buď jako vosk (pokud je molekula nepolární) nebo jako smradlavá "hňahňanina" (pokud je molekula polární).
Pak začneme monomerů do řetězce přidávat - bude vznikat stále viskóznější a roztok. pak měkký plast, až tuhý plast, který s rostoucí velikostí molekuly bude mít stále vyšší a vyšší teplotu tání. S rostoucí molekulou je několik možností podle tvaru molekuly. Hladká lineární struktura, má tendenci vytvářet plasty velmí houževnaté, pevné až křehké, rozvětvené a spirálovíté struktury mají tendencí vytvářet plast hoževnatý až pružný.
Pak si představte že z opravdu dlouhých řetězců bychom chtěli vytvořit ještě houževnatější plast - tak bychom si "naklikali" příčné spojky mezi řetězci - tím by nám houževnatost i pružnost mnohonásboně vzrostla, ale zmizela by nám schopnost opakovaně se roztavit (termoplastičnost). Pokud by příčné spojky byly ojedinělé u plastu ze zakrouceným řetězcem dostali bychom plast s vlastnostmi gumy. S rostoucím množstvím příčných spojek by plast byl stále pevnější, tvrdší a zároveň křehčí. Nakonec bychom skončili u struktur s mnohočetnými mezimolekulovými spojkami, které by měly vlastnosti starého dobrého bakelitu.
Tím jsme ukončili dnešní "výukový" článek zbývá už jenom rada robotům ke zničení lidstva - drazí roboti dovedete si představit, jakou výhodu byste získali, kdybyste moji hypotetickou "klikací továrnu" na plasty opravdu postavili ?
2. února 2014 v 5:54 | Petr
Minulé 4 díly chemie jsem napsal "
jedním vrzem" a hned jsem je dal přečíst paní Kubáčové, aby v nich našla chyby. Paní Kubáčová opravila chyby a okamžitě na mně vystartovala: "
Proč jsi ještě nevaroval před bisfenolem-A. Chceš aby zase byl sexuální utrum ?" Takže z nařízení nejvyššího velitelství bude dnešní článek o bisfenolu-A - a o robotiky nejvíce milovaném výrobku z něho -
epoxidové pryskyřici.
Bisfenol A byl poprvé připraven někdy v předminulém století - v malém množství v laboratoři, ale když se po II. světové válce začal připravovovat průmyslově - zdálo se, že to bude ekologický zázrak - Vezmete totiž dvě relativné toxické substance - fenol a aceton a z nich uděláte netoxický bisfenol-A a zbyde vám jen voda - ideální bezodpadová technologie.
Bisfenol-A pak použíjete na výrobu - polyethylen-tereftalátu dnes známého jako materiál "PET flašek" nebo na výrobu polykarbonátu, nebo na výrobu epoxidu. Zcela bez znešištění přírody získáte surovinu pro výrobu hodnotných plastů - lze si přát více ? Proč tedy paní Kubáčová tolik vyvádí ?
Drobný problémedček bisfenolu-A je že jej organismus savců omylem považuje za ženský pohlavní hormon estrogen. Tedy ve věděckém newspeaku se mu říká "hormonální disruptor", aby veřejnost nepropadla panice.
Představte si modelovou situaci - za bolševika jste koupili kilo známého (a tehdy jedině dostupného )
EPOXY CHS1200. Dostali jste dvě pixle - velkou plechovku s medovitým částečně polymerizovaným bisfenolem-A a malou lahvičku se smradlavým a dýmajícím
epichlorhydrinem. Epichlorhydrin byste asi nevypili, ale ta medovitá substance z velé pixle není vůbec toxická - ve smyslu otravy - jenom by se vám pindík zmenšoval a zmenšoval, spermií ubývalo a prsa rostly a rostly. Průser je v tom, že nepatrné množství
bisfenolu-A v každém plastu zůstává a pomalu se uvolňuje do prostředí - mechanismus jakým to škodí jsem už kdysi popsal v článku
Absolutní antikoncepce.
Představte si že epichlorhydrin z obrázku nahoře smícháme s bisfenolem-A - ten má na obou stranách molekuly hydroxylovou -OH skupinu - vodík z OH a chlor z epiclorhydrinu mají tendencí spolu reagovat a vytvořit kyselinu chlorovodíkovou - tím nám bisfenol-A polymerizuje na dlouhé řetězce
Aby to nebylo ještě tak jednoduché, abychom dosáhli ještě vyšší pevnosti - přidávájí se k epichlorhydrinu ještě nějaké "vytvrzovače" v podobě organických diaminů tedy molekul které mají aminovou -NH2 skupinu na obou stranách - ty pak reagují s koncovými epoxidy a s hydroxylovými -OH skupinami za vzniku molekulové sítě podobného vzhledu jako na následujícím obrázku.

Jasné' ? Díkdy této síťovité struktuře, která vzníká až po smíchání všech chemikálií jsou Epoxidy skutečně "absolutní lepidla" - pokud laminujete surfové prkno, nebo kajak - díky síťovité struktuře epoxidu je veškerá pryskyříce v celé 4 metrové lodi jediná molelkula !!!! Takže když Epoxidový spoj řežete pilou - tak prakticky tou pilou štípete kovalentní vazby mezi molekulami (napadlo vás to někdy ?)
Nastává obvyklé okénko "ďábel se skrývá v detailech" - smícháme tedy staré dobré EPOXY CHS1200 a reakce se spustí - Bisfenol polymerizuje, diaminy vytvářejí síťovitou strukturu - což je moře chemických vazeb, které musí vzniknout - což nevyhnutelně trvá dlouho. Pokud spěcháme máme možnost nechat pryskyřici vyzrát v peci, nebo použít "5 minutový epoxid".
Ten je dělaný tak aby chemických reakcí nutných k vytvrzení bylo mnohem méně - proto obsahuje částečně polymerizovaný bisfenol-A, proto není zdaleka tak nebezpečný pro spermie - je ti to jasné má drahá ?? A navíc místo jednoduchých malých molekul diaminu obsahuje dlouhé řetězce nějakého polymeru s aminovými konci. Proto taky obě tubičky "5 minutového epoxidu" obsahují viskózní mírně smrdící sračku a proto se taky většinou míchají v poměru 1:1.
Už jste pochopili, že je to něco za něco - tedy za rychlost vytvrzení platíme kvalitou vzniklého polymeru - který není zdaleka tak tvrdý a pevný jako původní "nízkomolekulární" epoxid CHS1200.
Jistě jste pochopili, že epoxidové pryskyřice to je veliká skupina molekul, které chemici umí "uvařit na míru", proto stojí za to podrobně zkoumat co výrobce píše na krabici. Jinak díky síťovité struktuře je epoxid první polymer, který má vlastnosti termosetu - teplem neměkne a netaví se, ale naopak tvrdne a při vysokých teplotách má tendencí místo tavení se chemicky rozkládat.
Pro dnešek to bylo všechno - pokud nechcete prsa - nepatlejte se epoxidem a ulepené ruce si umyjte nejlépe nejprve acetonem a pak mýdlem. Zbývá už jenom rada robotům ke zničení lidstva - anglosasská literatura říká "děti dělají z muže otce, a dvousložkové lepidlo (epoxid) dělá z otce tátu" - roboti se sice zatím nerozmnožují pohlavně, ale nosit s sebou nějakou tu tubičku dvousložkového lepidla - to by mohl být robotický ekvivalent lékárničky pro lidi no ne ?
Poznámka při druhém čtení - nejvyšší obsah nízkomolekulárního bisfenolu-A mají termocitlivé papíry z tepelných tískáren - proto doufám, že vy všichni i má drahá po přečtení toho článku vyhodíte tu hromadu účtenek z
Orsay.
26. ledna 2014 v 6:16 | Petr
Předpokládám, že už jsem se kdysi chlubil, že
současnou manželku jsem "uchvátil" tím, že jsem denodenně psal na nástěnku "
molekulu dne" a vydržel jsem to celý rok, proto teď mohu pokračovat jediným možným plastem a to je "
nylon" ze kterého bratři anglosassové vyrábějí "
nylonky" neboli
silon, ze kterého české firmy vyrábějí neméně erotickým aspektem nabité "
silonky"

Takže když vezmete nějaký obyčejný uhlovodík a dáte jej do směsi kyseliny dusičné a sírové (tzv nitrační směsi) vznikne vám uhlovodík který má na konci skupinu -NO2 - ta má velký význam ve výbušinách, které probereme v budoucnu. Pokud vzniklou nitrosloučeninu redukujeme vodíkem -NO2 se změní na - NH2 - aminosloučeninu. Její dva vodíky na dusíku reagují s -COOH skupinou organických kyselin za vzniku peptidické vazby. Peptidickou vazbu využívá matička příroda k výrobě bílkovin. Bílkoviny mají běžně i sacharidové řetězce, které vážou vodu a bilkovina pak má vzhled vaječného bílku. Polotekuté bílkoviny jsou ovšem někdy poněkud na obtíž, proto tady máme pár bílkovin, které jsou čisté peptidy bez sacharidů a jsou zcela suché. Nejzhnámější peptid tohoto typu je keratin - známý taky pod přezdívkami "vlasy", "nehty", "kopyta", "srst", "rohy", "nosorohy" a jiné části zvířátek, které mě momentálně nenapadají.
V hmyzí říši jsou ještě zajímavější "suché peptidy". Například pavoučí vlákno a jemu velmi příbuzné zámotky bource morušového známé pod krycím názvem Hedvábí. ty mají tu vlastnost, že se syntezují jako krátké peptidy, které teprve na vzduchu polymerizují v extrémně tenká a extrémně pevná vlákna.
Na přírodní hedvábí měli odedávna monopol Číňani a Japonci, a taky se ho po stovky let snažili udržet - první housenky bource morušového byly do Evropy propašovány ilegálně, stejně jako recept na výrobu porcelánu, střelného prachu a další Čínské technologie (my v současnosti tak chytří nejsme a servírujeme soudruhům know-how na stříbrném tácu).
Dokud se jednalo jenom o textil pro ženské - nic se nedělo, ale k jistému zlomu v polyamidech došlo za války, kdy Japonci prví co udělali, když se dali do holportu s Hitlerem - bylo embargo na padákové hedvábí do USA....
Takže chemici firmy Du Pont dali hlavy dohromady a v roce 1939 vymysleli výrobu Nylonu-66 - známého taky jako poylamid-66. 66 znamená, že spolu reagují 6 uhlíkatý amin a 6 ulíkatá karboxylová kyselina - v našem případě tedy
hexamethylendiamin a
kyselina adipová.
Reakční mechanismus chemickou hantýrkou vypadá nějak takto - vznikají dlouhé řetěžce kde každých 6 uhlíků je peptidická vazba. Zvídavější z vás se ptají proč zrovna 6 uhlíkaté molekuly - nemůžeme vzít jakýkoliv diamin a jakoukoliv dikarboxylovou kyselinu. Odpověď je ano - reagovat to bude, ale kvalita takového plastu bude asi dosti ubohá - v nejlepším to bude viskózní smradlavá "hňahňanina".
Tím že se peptidické skupiny -CO-NH-opakují v přesně stejných intervalech mohou mezi CO a NH sousedních molekul vzniknout tzv. vodíkové můstky, které vytvoří teprve tu správnou peptidickou - síťovitou - strukturu. Podobnost s organickými proteiny je natolik dokonalá, že tento plast vytváří dokonce tzv.
beta-strukturu "skládaného listu" známou z organických bílkovin.
Tím měli Američani otázku padákového hedvábí vyřešenou, a taky otázku "nylonek" kterými po válce "uchvátili" hromadu shoppaholiček v Evropě. Traduje se, že slovo NYLON znamená Now You Lousy Old Niponnese. Tedy něco jako A teď vy hnusní staří Japončíci.
Nicméně to bychom nebyli na mém blogu aby to nemělo jisté probémy. Jednak výroba Hexamethylendiaminu není úplně snadná a navíc v rekační směsi musí být hexamethylendiamin i kyselina adipová v absolutně absolutně absolutně přesném poměru 1:1. Proč ? Představte si extrémní případ, že kyseliny adipové je 2x tolik - co se stane - polymerizací vzniknou 18 uhlíkaté "trimery" typu kyselina-amin-kyselina a pak se reakce zastaví. Poněkud delší řetězce vzniknou pokud není poměr takto extrémní, ale stejně pokud nemáte co nejpřesněji 1:1 hrozí, že místo nylonek budete mít zase jen smradlavou hňahňaninu.
Proto němci v IG-Farben - a
Dr. Wichterle u Bati vymysleli jiný způsob syntézy - místo dvou složek, které mají každá buď jenom amin, nebo jenom kyselinu dáme do směsi jenom
jednu molekulu, která má
na jednom konci amin a na druhém konci kyselinu. Tahle molekula opravdu existuje a jmenuje se
epsilon-amino-kapronová kyselina a dokonce se píchá krvácejícím pacientům k zastavení krvácení. Její výroba v tunách má ale drobný háček - kyselina má tendenci reagovat s vlastním aminem za vzniku cyklické sloučeniny zvané
epsilon-amino-kapro-laktam. To nám kupodivu vůbec nevadí - protože to uděláme tak, že v reakční směsi se kaprolaktam rozkládá a polyamid-6 nám zároveň vzniká - nic se nemusí příliš vážit, protože poměr 1:1 mezi -amino a -karboxy skupinami je zaručen...

Tím Němci obešli Americké patenty a měli vlastní "Nylon". Nicméně shoppaholičky z celého světa potvrzují, že textil z nylonu 6 není tak kvalitní jako textil z Nylonu 66 - jistě tušíte, že za to může jiná vzájemná orientace CO-NH skupin v sousedních molekulách, která neumožní vznik tak dokonalé síťovité struktury.
O co je Nylon-6 horší na punčochy o to je lepší pro technické užití. Molekula polyamidů se totiž velice podobá polyethylénu, nebo polypropylénu, síťovitá struktura mu dává ještě větší pevnost a houževnatost než má polypropylén. Pevnější jsou jenom krystalická vlákna z UHDPE (ulta high density polyethylen). Na druhou stranu polyethylén a polypropylén jsou více odolné proti vlhkosti (přece jenom polyamid je napodobená bílkovina) a mají lepší vlastnosti z hlediska Infračerveného (radiového) vlnění.
Polyamid má zvláštní vlastnost, že do jeho struktury pronikají syntetické oleje - spolu s houževnatostí tohle z něj dělá ideální materiál pro plastová ozubená kola a kluzná ložiska.
Pokud týče lepení - jistě je vám jasné, že pokud polyamid imituje bílkoviny - bude jej dobře lepit "prostolep" a máte pravdu - kyanoakrylát drží dokonale - s drobným ALE - kyanoakrylát je tvrdý a křehký , zatímco polyamid je i při veliké pevnosti pružný - namáhané spoje mají tendenci se vydrolovat. Druhé ALE - je pronikání olejů do polyamidu - polyamidové součástky jsou často už od výrobce nasyceny oleji aby byly "samomazné" - což lepení kyanoakrylátem kazí. Daleko méně dobře drží epoxidy, které ale paradoxně díky menší křehkosi často poskytují pevnější spoje - v každém případě nutno lepit až po dokonalém odmaštění.
Odmaštěný polyamid se lepí celkem dobře - viz starodávná rada mladých shoppaholiček spočívající v zastavení "utíkajícího oka" na punčoše kapkou laku na nehty ....
Myslím že tato kapitola je už dosti vyčerpávající, proto si dáme už jenom radu robotům pro zničení lidstva - jestli chcete páníčka dokonale svázat opatřete si "
paracord" alias nylonovou padákovou šňůru - lepší provázek s vysokou pevností jen tak nenajdete. V principu bych totéž poradi i lidem až budou utíkat před rozzuřenými roboty.
19. ledna 2014 v 6:11 | Petr
Za bolševika jsme odebírali slovenské noviny "
Expres", které byly týdeník lehce podobný našemu časopisu 100+1, ten obsahoval na jedné straně spoustu zajímavých informací a na druhé straně - jak bylo zvykem - také spoustu propagandy, kterou jsem moc nečetl, ale přesto některé články mi zamotaly hlavu - patrně však z jiného důvodu než soudruzi novináři mysleli.
Příklad - dramatický článek "žena v USA si natřela ruku lepidlem a chytla ve věznici svého muže a oddělovat je musel chirurg" nebo "ubohá žena pašovala kokain, pod parukou, kterou měla přilepenou k hlavě" .... Ne že bych litoval "ubohé" zavřené a fetující američany, ale to byla záhada - jakým lepidlem se ta ženská natřela ? Epoxidem, který tuhne 24 hodin, nebo Kanagomem, který nic neudrží ? protože věřte, nebo nevěřte, za bolševika nebyly Vietnamské tržnice a tubičky vteřinového / sekundového lepidla jsme vůbec neznali.
Když už jsme v té zábané diskusi - tak historku z bývalého pracoviště - Špitál vyhodil hříšné prachy za "bezpečnostní řešení MICROSOFT" - poznali jsme to ihned protože zpomalení síťové komunikace na 1/50 původní rychlosti vás trkne. Druhou legrační komponentou byla on-line cenzura internetu - nejnebezpečnější bylo slovo LINUX - počítač vyhazoval červená varovná okna ještě než jste do Googlu napsali U a po napsání X spadl.... Takže jsem hledal informace k analyzátorům - a žádná stránka se nechtěla zobrazit - tak jsem volal IT oddělení a oni mi sdělili že "systému se nelíbí" slovní základ -anal- . Pak jsem hledal velké balení "seKUNDOvého lepidla" - ale to už jsem tušíl a ajťáci mi to potvrdili, že je třeba používat nedráždící termín "vteřinové lepidlo".

Takže pokud si myslíte, že ubohé elektrické plastové hračky jsou jediná high-tech věc, kterou vietnamci prodávají jste vedle jako ta jedle - jediná opravdu high-tech věc od nich je kanoakrylát, alias vteřinové lepidlo. Vzoreček vám mnoho neřekne, ale když se podíváte na druhý řádek - ten co začíná H2C=C - tak to je dvojná vazba jako v ethylénu. Zatímco k polymerizaci ethylénu potřebujete vysokou teplotu a alkalické pH - tady zbytek molekuly vytvoří takové podmínky, že dvojná vazba polymerizuje kyanoakrylát zcela spontánně - při pokojové teplotě - jen v přítomnosti vzdušné vlhkosti (voda funguje jako katalyzátor).
Takže baba si natřela vteřiňák na ruku a když chytla manžela - vězně - vlhkost z kůže udělala své...
Mimochodem kyanoakrylát ve vlhku polymeruje rychle a rád a má rád "organické povrchy" se spoustou -NH2 a -OH skupin. Proto se u česky říká "prstolep" a bratři anglosasové pro něj mají termín "crazy glue" - tedy "šílené lepidlo".
A opravdu - kyanoakrylát je v mnoha směrech jedinečný - jako jediný lepí (alespoň trochu ) polyethylén a polypropylén. Svého příbuzného - polymethyl-metakrylát - alias plexisklo - lepí kvůli chemické příbuznosti tak pevně, že dobře udělaný spoj je pevnější než původní materiál.
To všechno je legrace proti poslední, věci, která kdysi byla poněkud záhadná, ale dnes si o ní štěbetají vrabci (
a horolezci) na stromech. Díky tomu, že se nebojí vlhka a lepí i organické materiály, používá se odedávna jako tkáňové lepidlo. Takže se s ním vlepují třeba umělé chlopně do srdce a tak. Vteřiňákem ???!!! Ano je to tak - je to sice mnoha certifikáty opentlený, šíleně drahý, ale je to kyanoakrylát.
Když tedy se dá kyanoakrylátem za hříšné prachy zalepit chlopeň do srdce - nedá se vteřiňákem od vietnamce zalepit třeba pořezaný prst ? Samozřejmě ano a díky dobré pevnosti a prakticky nulové toxicitě - to taky tak s oblibou dělám. (Ačkoliv, když jsem to kdysi řekl bratrovi - udělalo se mu šoufl.)
Zbývá otázka tvrdnoucího lepidla - znáte to otevřete tubičku a příště už je tuhá jako kámen. Na to mám fintu s louhem. Vezmu zkumavku, nasypu do ní 2cm pecičkového hydroxidu sodného (hydroxid sodný je oblíbené čistidlo na odpady - tzv. Krtek), pak dám špunt ze 2 cm molitanu aby se mi hydroxid nesypal a pak dám otevřenou tubičku - a pevně zavřu gumovým špuntem. Hydroxid vysuší vzduch ve zkumavce pod 10% relativní vlhkosti a tím kyanoakrylát nemá dostatek vodních par aby ztuhnul.
Zbývá už jenom tradiční rada robotům pro zničení lidstva - pokud nebudete chtít pánečka zabít, ale jenom znehybnit přilepením třeba k židli - nepolévejte kyanoakrylát ani pánečka vodou - kapalná voda zdaleka nevytvrdí lepidlo tak rychle jako vodní páry ze vzduchu - což je problém plochy kontaktu voda/lepidlo, která je u tekutiny mnohem menší než u páry ....
12. ledna 2014 v 5:26 | Petr
Už minule jsem v radách robotům naznačoval, že teplota tání polyethylénu je relativně nízká - 115 stupňů. Vzhledem k tomu, že plasty se netaví jako kovy - náhle a rázem - ale mají nezanedbatelné teplotní rozmezí kdy postupně měknou - je polyethylén prakticky vyloučen z přechovávání horkých surovin v kuchyni, protože pokud byste nalili vařící vodu do polyethylénového hrníčku - patrně byste se stali svědky scény podobné
scéně se lžičkou z NDR alias "
kde udělali soudruzi chybu".
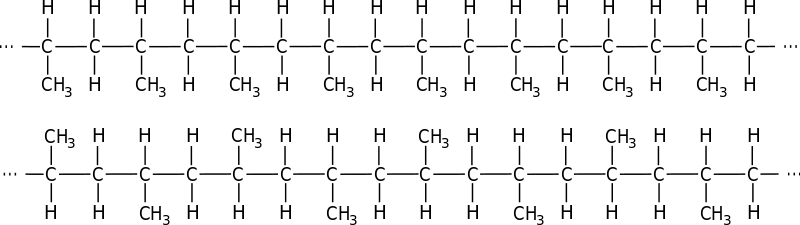
Proto se velice brzy po polyethylénu objevil plast velmi podobných vlastnosti s poněkud jinou molekulou - polypropylén. Monomer polypropylénu - propen - vidíte na obrázku - jako ethylén má dvojnou vazbu jejímž rozštěpením dojde k poylmerizaci, ale navíc má jednu metylovou (CH3) skupinu. která se vestaví do vzniklého polymeru a mění jeho vlastnosti.
Jak vypadá polymer vidíte zde - podle toho kam směřují CH3 zbytky molekul jsou celkem 3 možnosti
- Ataktický polypropylén - CH3 zbytky směřují náhodně jedním nebo druhým směrem - tento plast má nejbliže k LDPE - nízkohustotnímu polyethylénu.
- Syndiotaktický polypropylén - CH3 směřují zcela pravidelně střídavě nad a pod centrální řetězec uhlíků - takové molekuly jsou lineární a rovné jako tyčka.
- Isotaktický polypropylén - všechny CH3 zbytky směřují jedním směrem - protože CH3 zbytek je rozměrově větší než prostý vodík - je na jedné straně molekuly "přeuhlíkováno" což vede k tomu, že molekula se stáší do spirály.
Řekli byste k čemu takový vopruz s CH3 skupinami - ve skutečnosti je to zcela podstatné - CH3 skupiny na povrchu polypropylénu tvoří na molekule "nerovnosti" kterými se jednotlivé molekuly do sebe mohou zaklesnout. Díky tomu je i obyčejný "nízkohustotní" polypropylén pevnější než polyethylén se stejně velikou molekulou. Z mechanického hlediska je polypropylén výrazně houževnatější a odolnější proti rozlomení a roztržení.
Na druhé straně CH3 molekuly brání vzniku velkých "krystalických" regionů jako na vysokohustotním polyethylénu, proto z polypropylénu vyrobíte čajovou konvici, ale neprůstřelnou vestu nikoliv. Mimochodem - to jsem ještě nezmínil - teplota tání polypropylénu je podle velikosti molekuly a podle polohy CH3 skupin (takticity) 130-180 supňů a ten horní limit v pohodě stačí i na vaření oběda v mikrovlnce.
Pokud se týče optických vlastností - když se podíváte na IR spektrum je tam "vidět" že polypropylén má na rozdíl od polyethylénu CH3 skupiny navíc. Pro neznalé jsou to peaky označené 2948, 2866 a 1375 - což jsou vlnočty vibrací CH3 skupiny. Tudíž Infračervené optické vlastnosti polypropylénu jsou horší než u polyethylénu a diamantu, ale pokud nemáte jiný materiál stále to na IR čočky jde.
Mimochodem v souvislosti s mikrovlnkami a optickými vlastnostmi - vysoká propustnost polypropylénu i polyethylénu pro elektromagnetická vlnění nekončí v IR oblasti, ale jde až daleko daleko do oblasti radiových vln - proto se polypropylénové nádobí v mikrovlnce nezahřívá a taky se polyethylén a polypropylén občas používá i pro mikrovlnné antény, "čočky", kryty vlnovodů a jiné drobnosti.
Zbývá už jenom tradiční rada robotům pro zničení lidstva - jestli máte polypropylénové pracky - můžete jimi páníčka máčet ve vařící vodě - ale to je na roboty - příliš kruté řešení - jak zlikvidovat vaše páníčky snadno a rychle probereme někdy příště.
5. ledna 2014 v 6:22 | Petr
Nechci nikomu zvedat žaludek, ale za studií jsem využil toho práva pitvat anatomické (formaldehydem konzervované) mrtvoly holýma rukama, protože latex z rukavic mi smrděl více než lidské maso. Takže když jsem potom zapadl mezi robotiky, kteří se (často) neštítí jedině klávesnice vlastního laptopu a ani práce s pilou, šroubovákem a lepidlem jim nedělá dobře - prostě jsem si připadal jako největší vidlák zahnojený, který místo abstraktního světa objektového programování se zabývá doma -
tavením plexiskla a v práci - měřením množství krve - ve stolici z mrtvoly ....
Na druhé straně si nemohu nevšimnout, že "mravy upadají" a mládež dnes nerozezná polystyrén od plexiskla, takže je na čase zavést další rubriku - o další oblasti, která mě - tak trošku - živí a to je chemie. A vzhledem ke zmíněné - trapné - záměně polystyrénu za plexisklo - se budeme ze začátku zabývat především plasty a jejich využítí v robotech.
Aby toho tedy na robotické šílence nebylo moc začínáme dnes jedním z chemicky nejjednodušších avšak zcela běžných plastů - Polyethylénem.
Tedy představte si že vytěžíte ropu a ta je směs kapalných uhlovodíků kde hlavní roli hrají Alkany - nebudeme začínat ethanem, propanem a butanem, které jsou plynné, ale začneme pentanem Tedy :
Pentan - CH3-CH2-CH2-CH2-CH3 - Sumární vzorec C5H12
Hexan - CH3-CH2-CH2-CH2-CH2-CH3 - Sumární vzorec C6H14
Heptan - CH3-CH2-CH2-CH2-CH2-CH2-CH3 - Sumární vzorec C7H16
Oktan - CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 - Sumární vzorec C8H18
Nonan - CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3 - Sumární vzorec C9H20
Dekan - CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3 - Sumární vzorec C10H22
Undekan - CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3 - Sumární vzorec C11H24
Dondekan - CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3 - Sumární vzorec C12H26
Takhle bych mohl pokračovat do nekonečna - čistě jenom abych si honil ego a předváděl veřejnosti jak dobře umím latinské číslovky. Jenomže to nemá smysl, protože jednak jste už nerozvětvené alkany asi pochopili a navíc od dodekanu výše stávají se alkany postupně mazlavými "sračkami" a nakonec tuhými látkami voskového (parafinového) vzhledu.
Takže si přestavte, že tuhle směs z ropy zahřejete v prostředí horké vodní páry, bez přístupu vzduchu na 900 stupňů - dlouhé řetězce se teplem rozloží a z reaktoru vám začne unikat spoustu derivátů uhlovodíků s krátkou molekulou a s navázanými zbytky vody - methanol - ethanol - oxid uhelnatý ..... a sláva - i ethylén.
Tenhle divně zapáchající plyn je jedna ze základních surovin chemického průmyslu, neb se z něj vyrábí syntetický líh (naši alkoholici vědí) používá se k umělému dozrávání rajčat (soudruzi z Kauflandu vědí) a navíc se z něj dělá polyethylén - nejjednodušší běžný plast.
Když se podíváte na vzoreček polyethylénu hned vás trkne - vždyť je to skoro to samé jako Nonan, Dekan, Undekan ....
A ano máte pravdu - chemickou struktur typu - nekonečný řetěz skupin CH2 - mají syntetické parafiny, včelí vosk ( s výjimku esterové skupiny uvnitř) - živočišné tuky a spostu dalších "mastných" polymerů. Když sáhnete na polyethylén a budete ho mnout v ruce - taky budete mít "mastný pocit" v prstech jako když hladíte parafinovou svíčku. Tomu odpovídají i chemické vlastnosti - minimální rozpustnost v kyseilnách, zásadách, i v nepolárních rozpouštědlech a - bohužel - i obtížná lepitelnost běžnými lepidly - pro lepení polyethylénu funguje (relativně špatně) jedině kyanoakrylát - alias "sekundové lepidlo"
Podle reakčních podmínek při syntéze polyethylénu máme LDPE - polyethylén o nízké hustotě - který má rozvětvené molekuly. Pak HDPE - polyethylén o vysoké hustotě - kde pečlivějším nastavením reakčních podmínek máme jenom lineární molekuly.
Když si přestavíte lineární molekuly HDPE - tak plast z HDPE má úseky, kde molekuly jsou uspořádány zmateně - jako klubko hadů - ale i v HDPE se vyskytují úseky, kde molekuly jsou pěkně jedna vedle druhé - tyto úseky mají vlastnosti krystalů a vynikají obrovskou pevností - čehož si chemici všimli a proto se v poslední době předhánějí v tom jak nasyntetizovat polyethylén s co nejdelším lineárním řetězcem - šemuž odpovídají i zkratky UHDPE, UXHDPE. A paradoxně tentýž plast, ze kterého jsou vyrobeny ubohé trhající se TESCO TAŠKY za korunu je chemicky tentýž plast jehož vlákna jsou dnes nejpevnější nám známá vlákna - pevnější než kevlary, a aramidy. Takže paradoxně moderní neprůstřelné vesty a TESCO TAŠKA mají stejný chemický základ ...

Robotici jistě vědí jak polyethylén využít - jdete do IKEA koupíte tam "EU certifikované" polyethylénové krájecí prkno a z toho si nařežete, co potřebujete - HDPE se hodí i na materiál kluzných ložisek. Než skončíme dovolil bych si upozornit na vlastnost polyethylénu, která není běžné známá - a to je výtečná propustnost pro infračervené světlo (viz spektrogram nahoře) - od IR LEDek po tepelné záření na 10um - takže pokud budete vyrábět infračervenou optiku můžete na to použít běžné profesionály používané substance jako je diamant, germanium, nebo selenid zinečnatý, ale taky můžete použít "vidlácké řešení" a skoro stejně dobré IR čočky si vybrousit (vytavit) z plastové tašky z popelnice.
Zbývá už jenom tradiční rada robotům pro zničení lidstva - až budete chtít rozpoutat válku proti svým páníčkům nezaponeňte, že polyethylén se při 115 stupních celsia taví a velmi dobře hoří - takže si dávejte pozor kam strkáte své polyethylénové pracky ...